domingo, 24 de enero de 2010
viernes, 22 de enero de 2010
martes, 12 de enero de 2010
jueves, 7 de enero de 2010
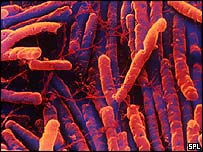
Clostridium Difficile
Clostridium difficile es una especie bacteriana del género Clostridium, los cuales son bacilos gram positivos formadores de esporas,anaerobios estrictos. C. difficile es parte de la flora intestinal normal en un pequeño número de individuos sanos y de pacientes hospitalizados.1 C. difficile es la causa más importante de colitis seudomembranosa,2 una infección del colon, con frecuencia secundario a la erradicación de la flora saprófita por el uso extenso de antibióticos. El tratamiento por lo general está basado en suspender los antibióticos con excepción de anti-costridiales, como el metronidazol.
Las Clostridia son bacterias móviles que se encuentran universalmente en la naturaleza, con especial prevalencia en la tierra. Bajo elmicroscopio se ven como palillos de fósforos con un abultamiento localizado en un extremo terminal. Las células de Clostridium difficile son Gram positivas y las colonias muestran un crecimiento óptimo al ser sembradas sobre agar sangre a temperaturas corporales humanas. Cuando el medio que los rodeo se vuelve estresante, la bacteria produce endosporas que toleran las condiciones extremas que de otro modo destruiría al El microorganismo es ubicuo. Coloniza el intestino de una pequeña proporción de individuos sanos (menor al 5%). La exposición a antibióticos se asocia con el sobrecrecimiento y posterior enfermedad (infección endógena). C. difficile es resistente a la mayoría de los antibióticos, más aún, es capáz de crecer bajo esas condiciones. Se transmite de persona a persona por la ruta oral-fecal. Debido a que el organismo forma esporas resistentes al calor (termoresistentes), puede permanecer en un hospital o ancianato por largos periodos de tiempo. Puede ser cultivada de casi cualquier superficie del hospital. Por ejemplo, las esporas se pueden detectar en las habitaciones del hospital con pacientes infectados (fundamentalmente alrededor de las camas y baños), pudiendo ser una fuente exógena de infección (enfermedad nosocomial). Una vez que las esporas son ingeridas, pasan por el estómago ilesos por ser ácido-resistentes. Evolucionan a su forma vegetativa en el colon, donde se multiplican.
Se han observado que varios desinfectantes comúnmente usados en los hospitales no son capaces de matar la bacteria, y más bien puedieran promover la formación de esporas. Sin embargo, los desinfectantes con cloro son eficaces destruyendo los organismos.. Descritas por primera vez por Hail y O'Toole en 1935, el entonces llamado clostridium difícil, por su gran resistencia a los iniciales intentos de cultivar la especie y si era sembrada, crecía muy lentamente en los cultivos.3
Se han observado que varios desinfectantes comúnmente usados en los hospitales no son capaces de matar la bacteria, y más bien puedieran promover la formación de esporas. Sin embargo, los desinfectantes con cloro son eficaces destruyendo los organismos.. Descritas por primera vez por Hail y O'Toole en 1935, el entonces llamado clostridium difícil, por su gran resistencia a los iniciales intentos de cultivar la especie y si era sembrada, crecía muy lentamente en los cultivos.3
C. difficile es una bacteria comensal del intestino humano en una minoría de la población. Los pacientes quienes han estado por largo tiempo hospitalizados o en residencias de cuidados especiales tienen una mayor probabilidad de ser colonizadas por este organismo. En pequeños números, no tiende a causar daños de significado clínico. Los antibióticos, en especial los de actividad con amplio espectro, causan un desequilibrio de la flora intestinal, llevando a una sobrepoblación por el C. difficile. Ello conlleva a la colitis seudomembranosa.
La toxina producida por la C. difficile es la responsable de enfermedades gastrointestinales asociadas a antibióticos, que van desde una diarrea relativamente benigna y autolimitada, hasta una colitis seudomembranosa grave que pone en riesgo la vida.
El microorganismo es ubicuo. Coloniza el intestino de una pequeña proporción de individuos sanos (menor al 5%). La exposición a antibióticos se asocia con el sobrecrecimiento y posterior enfermedad (infección endógena). C. difficile es resistente a la mayoría de los antibióticos, más aún, es capáz de crecer bajo esas condiciones. Se transmite de persona a persona por la ruta oral-fecal. Debido a que el organismo forma esporas resistentes al calor (termoresistentes), puede permanecer en un hospital o ancianato por largos periodos de tiempo. Puede ser cultivada de casi cualquier superficie del hospital. Por ejemplo, las esporas se pueden detectar en las habitaciones del hospital con pacientes infectados (fundamentalmente alrededor de las camas y baños), pudiendo ser una fuente exógena de infección (enfermedad nosocomial). Una vez que las esporas son ingeridas, pasan por el estómago ilesos por ser ácido-resistentes. Evolucionan a su forma vegetativa en el colon, donde se multiplican.
Se han observado que varios desinfectantes comúnmente usados en los hospitales no son capaces de matar la bacteria, y más bien puedieran promover la formación de esporas. Sin embargo, los desinfectantes con cloro son eficaces destruyendo los organismos
Enfermedades causadas por C. difficile:
- Colonización asintomática.
- Diarrea asociada a antibióticos.
- Colitis pseudomembranosa.
La enfermedad por C. difficile se confirma con el aislamiento del microorganismo o con la detección de la citotoxina o la enterotoxina en las heces del paciente.
El cultivo de Clostridium difficile puede ser útil en ciertas circunstancias: cuando la sospecha clínica permanece alta a pesar de un ensayo de citotoxicidad negativo, y cuando el tipado de la cepa y el estudio de susceptibilidad puede ser requerido para estudio epidemiológicos.
La estudio de la citotoxicidad en cultivo celular, con o sin neutralización es considerado con frecuencia el test diagnóstico estandard de oro para la colitis por Clostridium. Sin embargo el método de dos pasos combinando el cultivo con la citotoxicidad reta a la citotoxicidad sola para el estatus del estandard de oro pues lo anterior detecta de 15 a 23 % más aislamientos de C. difficile toxigénico. El estudio de citotoxicidad permite la detección de los dos tipos de cepas toxigénica A+/B+ y A-/B+.
El ELISA es fácil de usar, de resultado muy rápido, y capacidad de producir los resultados de lotes de muestras aunque el costo por test puede ser algo elevado cuando se procesan muchas muestras. Muchos kit comerciales poseen baja sensibilidad de detección aunque los protocolos que usan EIA dirigidos a toxinas como un método confirmatorio siguiendo test de screening dirigido a antígeno de Clostridium difficile más sensible puede solventar esta preocupación. La detección de toxina A sola puede que no se detecte aquellas cepas A-/B+ que han causado enfermedad severa en varios brotes. La detección de glutamato deshidrogenasa sola no puede discriminar entre aislamientos toxigénicos y no toxigénicos.
La recidiva es frecuente, debido a que las esporas no se ven afectadas por los antibióticos; un segundo ciclo de antibióticos con el mismo antibiótico suele tener éxito. Se debe limpiar a fondo la habitación del hospital después que el paciente se dé de alta.
martes, 5 de enero de 2010
Acinetobacter. Apuntes generales
Acinetobacter es un género de bacterias Gram-negativas que pertenece al filo Proteobacteria. Las especies de Acinetobacterson bacilos estrictamente aerobios no fermentantes, no móviles, oxidasa-negativos que se presentan en pares al microscopio. Se distribuyen ampliamente en la naturaleza, son importantes en el suelo y contribuyen a su mineralización.
Acinetobacter es también una importante fuente de infección en los hospitales para los pacientes debilitados.1 Son capaces de sobrevivir en diversas superficies (tanto húmedas como secas) en el ámbito hospitalario. Ocasionalmente son aislados de los productos alimenticios y algunas cepas son capaces de sobrevivir sobre diversos equipos médicos e incluso sobre la piel humana sana.
Muchas aislaciones de A. baumannii son multiresistentes a antibióticos, contenidos en su pequeño genoma, aislando islas de ADN extraño (significa transmisión genética desde otros organismos) y de otros materiales citoplasmáticos y genéticos; todo motiva su mayor virulencia.2 Acinetobacter no tiene flagelos; su nombre es en griego para 'sin motilidad'
Las especies del género Acinetobacter presentan predominantemente una morfología de tipo cocobacilo. Los bacilos predominan en los medios fluidos, especialmente durante el inicio del crecimiento. Sin embargo, la morfología puede ser variable en los especímenes teñidos en el laboratorio, por lo que no se puede usar para identificar Acinetobacter de las otras causas de infección.
La mayoría de las cepas de Acinetobacter, excepto algunas de A. lwoffii, crecen bien sobre el agar MacConkey (sin sal). Aunque oficialemente se clasifican como no fermentantes de la lactosa, a menudo pueden fermentar parcialmente la lactosa cuando crecen sobre el agar MacConkey.
Las diferentes especies de este género se pueden identificar usando FLN (Desnitrificación Fluorescente de la Lactosa) para determinarr la cantidad de ácido producido por el metabolismo de la glucosa,
El género Acinetobacter comprende 17 especies validadas y 14 sin validar (genómicas).2 Algunas especies no validadas tienen denominaciones populares, mientras que otras tienen varias distintas lo que causa confusión. Todavía es bastante limitado el conocimiento de la biología y ecología de las acinetobacterias a nivel de especies, debido a la dificultad de su diferenciación. Auque se han empleado métodos fenotípicos para la identificación de las especies, se espera que lo métodos basados en secuenciacón de nucleótidos sean el método estándar de identificación en el futuro.2
Sin embargo, puesto que no es posible la identificación rutinaria en los laboratorios clínicos todavía no es posible, el género se divide y agrupa en tres complejos
- Acinetobacter calcoaceticus-baumaniix: complejo oxidante de la glucosa no hemolítico (A. baumannii puede identificarse por OXA-51)
- Acinetobacter lwoffii: negativo a la glucosa, no hemolítico
- Acinetobacter haemolyticus: hemolítico
En pocas palabras, la clasificación taxonómica de Acinetobacter es desconcertante. Sin adentrarnos en este laberinto, el género se subdivide en dos grupos: especies oxidadoras de glucosa (entre las que A. baumannii es la especie más frecuente) y especies no oxidadoras de glucosa (entre las que destaca A. lwoffli). Las acinetobacterias son cocobacilos anchos gramnegativos oxidasa-negativos que se desarrollan como aerobios estrictos. Crecen como saprófitos ubicuos en la naturaleza y en el entorno hospitalario. Sobreviven en las superficies húmedas, como los equipos de terapia respiratoria, y en las superficies secas como la piel del ser humano (esta última característica es rara en los bacilos gramnegativos). Estas bacterias forman también parte de la microflora bucofaríngea normal de un pequeño número de individuos sanos, y pueden crecer hasta alcanzar un número elevado durante la hospitalización.
Las acinetobacterias son patógenos oportunistas que pueden producir infecciones de los aparatos respiratorio y urinario, y de las heridas; también pueden causar septicemia. Los sujetos con riesgo de contraer una infección por estas bacterias son los que reciben antibióticos de amplio espectro, los que se encuentran en fase postoperatoria quirúrgica, o los sometidos a ventilación mecánica. El tratamiento de las infecciones por Acinetobacter es problemático, porque estos microorganismos, especialmente A. baumannii, son a menudo resistentes a los antibióticos. El tratamiento específico debe orientarse por las pruebas de sensibilidad in vitro, pero el tratamiento empírico frente a las infecciones graves sería un b-lactámico (p. ej., ceftacidima, imipenem) y un aminoglucósido.
Acinetobacter entra al cuerpo por heridas abiertas, cateteres, tubos de respiración. Usualmente infecta a los comprometidos inmunodeprimidos, como los heridos, ancianos, niños con enfermedades del sistema inmune, trasplantados. Su colonización no representa ninguna amenaza para los sanos, aunque trabajadores de atención de la salud colonizados y visitantes de hospital pueden llevar la bacteria a barrios vecinos y a otras instalaciones médicas .4 El número de infecciones hospitalarias causadas por A. baumannii se ha incrementado en años recientes; al igual que la mayoría de los patógenos nosocomiales (MRSA, VRSA, VRE, etc.)5
Los primeros brotes militares graves de infecciones de A. baumannii ocurrieron en abril de 2003 en soldados estadounidenses de retorno de Iraq. Los primeros reportes atribuían las infecciones al suelo iraquí. Más tarde las pruebas bioquímicas demostraron una amplísima contaminación de hospitales de campaña, vía el transporte de personal y de equipo desde previo hospitales europeos contaminados, como el más plausible vector.
Las especies de Acinetobacter se consideran en general no patogénicas para los individuos sanos. Sin embargo, varias especies persisten en los entornos hospitalarios y causan infecciones graves que ponen en peligro la vida de los pacientes inmuncomprometidos.1 El espectro de resistencia a los antibióticos de estos organismos, junto con sus capacidades de supervivencia las hacen que una amenaza seria para los hospitales, tal como se documenta por los brotes recurrentes incluso en los países desarrollados. La mayoría de las infecciones ocurren en individuos inmunocomprometidos, siendo la cepa A. baumannii la segunda bacteria no fermentante más frecuentemente aislada en muestras humanas.
Un factor importante para su potencial patógeno es, probablemente, una eficiente transferencia horizontal de genes, aunque este mecanismo de momento sólo ha sido observada y analizada en Acinetobacter baylyi, una especie que vive en el suelo que nunca se ha asociado con infecciones.1
Acinetobacter es frecuentemente aislado en infecciones nosocomiales y es especialmente frecuente en las unidades de cuidados intensivos, donde tanto los casos esporádicos como los epidémicos y endémicos son comunes. A baumannii es una causa frecuente de neumonía nosocomial, sobre todo asociada a la ventilación mecánica. Puede causar otras infecciones incluidas infecciones de la piel y de la heridas, bacteriemia y meningitis, pero A. lwoffi es el principalmente responsable de este última. A. baumannii puede sobrevivir en la piel humana o superficies secas por semanas.
Se ha descubierto que el etanol estimula la virulencia de A. baumannii en los estudios del modelo del huésped meiofaunal.7 Se ha comprobado en gusanos nemátodos infectados por A. baumannii que la aplicación de etanol reduce su tiempo de vida y dismuye el número de huevos.
Desde el comienzo de la guerra de Iraq, más de 700 soldados de EE.UU. han sido infectados por A. baumannii.
Las especies de Acinetobacter son resistentes naturalmente a muchos tipos de antibióticos, incluida la penicilina, cloranfenicol y a menudo los aminoglucósidos. Se ha informado de la resistencia a fluoroquinolonas durante la terapia y esto también ha dado lugar a un aumento de resistencia a otras clases de drogas a través del reflujo activo. El CDC ha informado de un aumento espectacular de la resistencia a los antibióticos en cepas de Acinetobacter y los carbapenem son reconocidos como el último recurso.
Más preocupante es el aumento de la resistencia a los carbapenem, que deja muy pocas opciones de tratamiento si bien se han conseguido algunos éxitos con polimixina B, así como el uso de nuevas combinaciones de antibióticos.8 Las especies de Acinetobacter son inusuales en el sentido de que son sensibles al sulbactam. Esta sustancia se usa normalmente inhibir la lactamasa bacteriana, pero este es un ejemplo de la propiedades antibacterianas del sulbactam.9
Algunos informes sugieren que esta bacteria es susceptible a la terapia con fagos.10 Fagos dirigidos contra Acinetobacter mostraron una notable actividad lítica tanto in vitro como in vivo: tan sólo 100 ufp de fagos protegieron a los ratones frente a Acinetobacter.11
La institución de medidas estrictas de control general de infeccions, como el monitoreo bacteriológico del higiene de manos, puede bajar la tasa de infecciones hospitalarias.
Muchas de las características de Acinetobacter, ecología, taxonomía, fisiología y genética apuntan a la posibilidad de explotación de sus características únicas para aplicaciones biotecnológicas. Las cepas de Acinetobacter son a menudo omnipresentes, muestran una gran versatilidad metabólica, son robustas y algunas son adecuadas para los sistemas modernos de manipulación genética molecular. Estas características están siendo explotadas en diversas aplicaciones biotecnológicas incluyendo la biodegradación y biorremediación, la producción de lípidos y péptidos, ingeniería de enzimas, producción de biosurfactantes y biopolímeros y la ingeniería de nuevos productos derivados de estos productos. Se prevé que los avances en estos campos ampliarán la gama de aplicaciones de la biotecnología moderna para Acinetobacter
viernes, 1 de enero de 2010
Suscribirse a:
Entradas (Atom)