jueves, 25 de marzo de 2010
Sueroterapia
Todo sobre soluciones hipo, hiper isotónicas y demás. Un artículo breve pero explicativo, dirigido al personal de enfermería-
Ver link
miércoles, 24 de marzo de 2010
Linesolid
Linezolid es un antibiótico sintético de acción sistémica.
Fue el primer antibiótico comercializado del grupo de las oxazolidinonas y suele reservarse para el tratamiento de infecciones bacterianas graves donde otros antibióticos han fracasado por haber generado resistencia a los antibióticos. Está indicado en infecciones de la piel y tejidos blandos, neumonía nosocomial o adquirida en la comunidad e infecciones porEnterococcus faecium resistente a vancomicina, siempre que se evidencie o se sospeche resistencia a meticilina.
Mecanismo de Acción
Su mecanismo de acción consiste en inhibir la síntesis proteica de la bacteria al impedir la formación del complejo de iniciación (es el único antibiótico que actúa a este nivel). Se esperaba que las bacterias no pudieran desarrollar resistencia a este antibiótico, pero ya se han observado, in vitro, cepas de enterococos (Enterococcus faecium y Enterococcus faecalis) resistentes a linezolid, y también cepas de Staphylococcus aureus resistente a meticilina con susceptibilidad reducida a este antibiótico. También se han aislado cepas resistentes en un paciente sometido a diálisis que estaba siendo tratado con linezolid por una peritonitis producida por Staphylococcus aureus resistente a meticilina.
Farmacocinética
Se absorbe muy bien después de administrarse por vía oral. Puede administrarse independientemente de los alimentos. Presenta una biodisponibilidad oral cercana al 100%, así que la dosificación oral e intravenosa es la misma. La vida media es de aproximadamente 4 a 6 horas.
Espectro de acción
Linezolid sólo es activo frente a cocos gram-positivos, sobre todo Enterococcus faecium, Staphylococcus aureus, Streptococcus agalactiae, Streptococcus pneumoniae, y Streptococcus pyogenes. No tiene efecto sobre bacterias gram-negativas.
El linezolid está comercializado en España con el nombre de Zyvoxid, en forma de comprimidos, polvo para suspensión oral, o solución para perfusión intravenosa.
Efectos adversos
Los más frecuentes son reacciones cutáneas, pérdida del apetito, diarrea, náuseas, estreñimiento, insomnio, dolor de cabeza y confusión y fiebre. Más raramente pueden aparecer reacciones alérgicas, colitis pseudomembranosa, acidosis láctica o trombocitopenia. Linezolid es un inhibidor de la monoamino oxidasa (IMAO), por lo que debería evitarse un consumo excesivo de alimentos ricos en tiramina y otras aminas (como bebidas alcohólicas, hígado de pollo y vaca, quesos añejos, extracto de levadura, arenques salados, etc.) por el riesgo de desencadenar crisis hipertensivas.
viernes, 12 de marzo de 2010
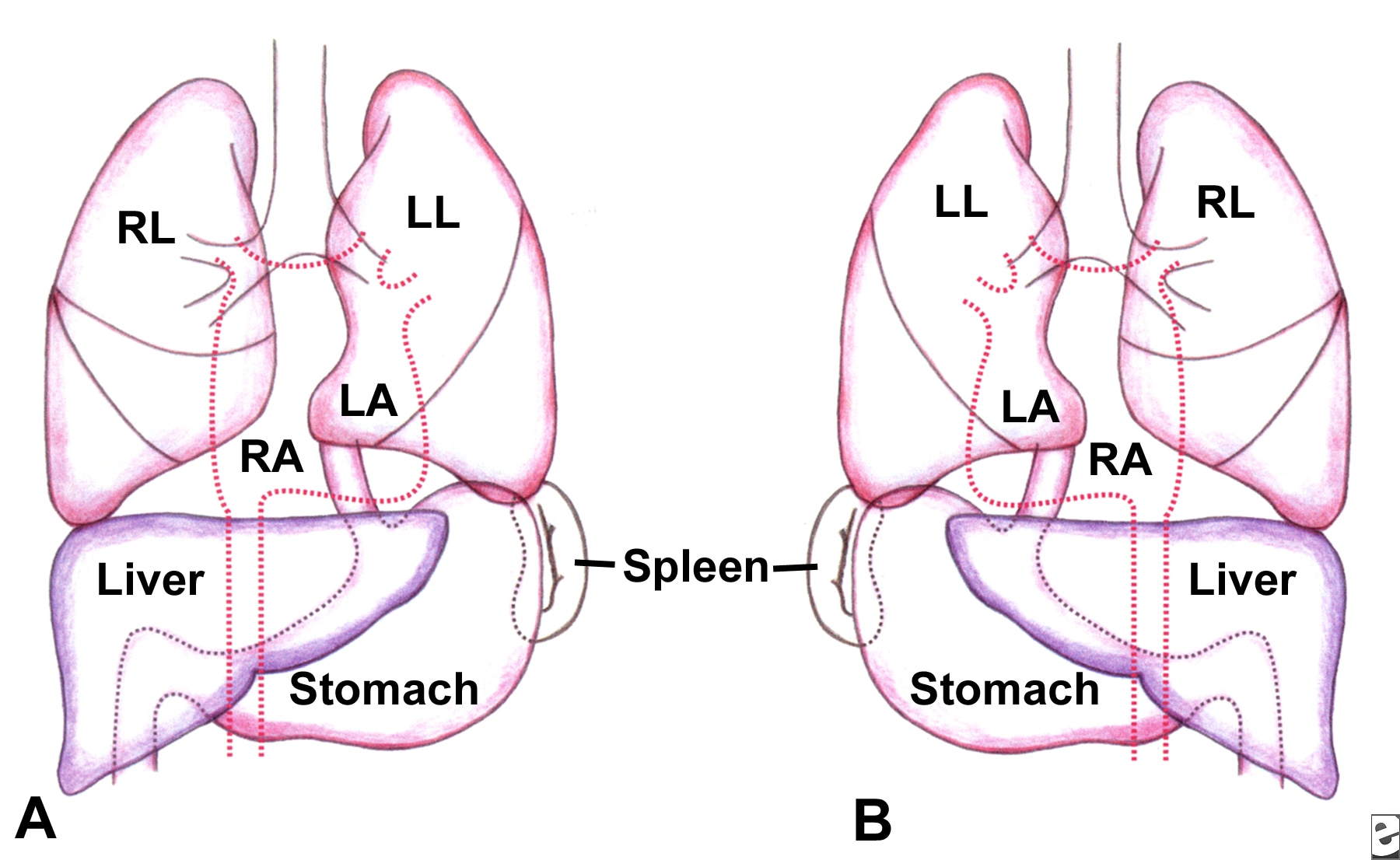
Situs Inversus
El Situs inversus es una rara malformación genética que puede afectar a varios órganos y tiene un carácter hereditario. Consiste en una alineación errónea de los órganos dentro del cuerpo, colocándolos del lado opuesto (imagen de espejo).
El término situs inversus es la forma abreviada de la frase en Latín, situs inversus viscerum, significando posición invertida de los órganos internos. La Dextrocardia (el corazón situado en la parte derecha del tórax) fue descrita por primera vez por Marco Severino en 1643. Sin embargo,situs inversus fue descrito un siglo más tarde por Matthew Baillie.
Generalmente va asociado a otras malformaciones, tales como poliesplenia, Síndrome de Kartagener, etc. Suele representar un serio riesgo para la vida pues en la mayoría de los casos va acompañado de malformaciones cardíacas (véase Dextrocardia). También representa un problema en cuanto a la presentación de síntomas de algunas enfermedades, por ejemplo laapendicitis en un paciente con situs inversus presenta el dolor en el lado izquierdo, al igual que en el caso de un infarto al corazón en el cual el dolor característico se ubica en el brazo derecho.
Lo más recomendable, en el caso de que se opte por una cirugía, es recopilar la mayor cantidad de información posible, debido a posibles complicaciones que pueden no haber sido descubiertas con exámenes demasiados superficiales.
Es posible que el intercambio de lateralidad cerebral psicomotriz sea también un caso común de Situs Inversus.
jueves, 11 de marzo de 2010
Déficit de Factor VII
Es un trastorno hereditario en el cual la falta (deficiencia) de la proteína factor VII en el plasma lleva a que se presente sangrado anormal.
Causas
Este trastorno ocurre cuando el cuerpo no tiene suficiente factor VII, una importante proteína en la coagulación de la sangre.
Cuando uno sangra, el cuerpo inicia una serie de reacciones que ayudan a que la sangre se coagule. El proceso involucra proteínas especiales, llamadas factores de coagulación, dentro de los cuales está el factor VII. El producto final de estas reacciones es el coágulo de sangre.
Cuando faltan ciertos factores de la coagulación, la sangre puede no coagularse normalmente y uno puede sangrar de manera anormal. El sangrado puede variar de leve a grave en la misma persona con el tiempo y puede comenzar durante la lactancia o la infancia.
Con mucha frecuencia, una deficiencia del factor VII es causada por:
- Enfermedad hepática severa
- Uso de fármacos que impiden la coagulación (anticoagulantes como warfarina y Coumadin)
- Falta de vitamina K debido al uso prolongado de antibióticos, obstrucción de las vías biliares o absorción deficiente de vitamina K de los intestinos
Algunos bebés nacen con deficiencia de vitamina K. Es muy raro nacer con deficiencia del factor VII debido a la incapacidad del cuerpo para producir dicho factor VII funcional.
Síntomas
- Sangrado de las membranas mucosas
- Sangrado intraarticular
- Sangrado intramuscular
- Hematomas excesivos
- Sangrado menstrual excesivo
- Sangrado nasal (epistaxis)
Pruebas y exámenes
- Tiempo parcial de tromboplastina ( TPT)
- Actividad del factor VII en el plasma
- Tiempo de protrombina ( TP)
Tratamiento
Los pacientes pueden controlar los episodios de sangrado recibiendo plasma normal, concentrados de factor VII o factor VII producido genéticamente (recombinante) por vía intravenosa (IV). Las personas necesitan tratamiento frecuente durante los episodios de sangrado, debido a que el factor VII no dura mucho tiempo dentro del cuerpo.
Las mujeres pueden controlar mejor el sangrado menstrual con el uso de anticonceptivos orales. Asimismo, se puede usar una forma del factor VII, llamada Novo-7.
Si una falta de vitamina K está causando el trastorno, usted puede tomar dicha vitamina por vía oral, a través de inyecciones subcutáneas o por vía intravenosa.
Grupos de apoyo
El estrés causado por la enfermedad a menudo se puede aliviar uniéndose a un grupo de apoyo, donde los integrantes comparten experiencias y problemas en común. Ver recursos para la hemofilia.
Pronóstico
El pronóstico puede ser bueno con tratamiento apropiado.
Se trata de un trastorno de por vida si se hereda de los padres. Si es causado por enfermedad hepática, el pronóstico depende de qué tan bien usted controle el problema del hígado.
Posibles complicaciones
- Sangrado excesivo (hemorragia)
- Accidente cerebrovascular u otros problemas del sistema nervioso a raíz del sangrado en el sistema nervioso central
- Problemas articulares en casos graves cuando el sangrado se presenta con frecuencia
Cuándo contactar a un profesional médico
Acuda al servicio de urgencias o llame al número local de emergencias (como el 911 en los Estados Unidos) si presenta sangrado intenso e inexplicable.
Prevención
La asesoría genética puede servir para trastornos que comiencen al nacer (congénitos). Tomar vitamina K puede ayudar si usted tiene deficiencia de esta vitamina.
Nombres alternativos
Deficiencia del factor extrínseco
Referencias
Kessler C. Hemorrhagic disorders: coagulation factor deficiencies. In: Goldman L, Ausiello D, eds. Cecil Medicine. 23rd ed. Philadelphia, Pa:Saunders Elsevier;2007:chap 180.
Síndrome de Hippel Lindau
El Síndrome de von Hippel-Lindau, también conocida por sus sinónimos: Angiomatosis familiar cerebeloretinal, hemangioblastomatosis o angiofacomatosis retiniana y cerebelosa, consiste en el crecimiento anormal de vasos retiniano-cerebelosos, y se cataloga como una enfermedad rara de carácter hereditario autosómico dominante, dentro del grupo de las facomatosis. La enfermedad fue descrita por dos grupos independientes, dirigidos por Eugen von Hippel (en 1894) y Arvid Lindau (en 1926). La causa de la enfermedad es la mutación de ambos alelos del grupo VHL, causada en el uno por factores genéticos y en el segundo tras unamutación de novo. El síndrome se caracteriza por aumentar la predisposición a los tumores deriñón, del sistema nervioso central —en particular el cerebelo— y por afectar a la retina. No existe por el momento un tratamiento médico de cura, pero el conocimiento de susintomatología y la investigación genética posibilitan que actualmente sea posible establecerdiagnósticos precoces antes de la aparición de las complicaciones derivadas de la proliferación de tumores.
Epidemiología
Un estudio realizado en Inglaterra cifra la frecuencia de esta alteración heterozigótica en torno a 1:53.000, es decir 1:36.000 nacimientos.1 Otra investigación realizada en Alemania estimó la frecuencia de la enfermedad en 1:38.000.2 Se calcula que en Polonia viven alrededor de 1000 personas afectadas del síndrome de Hippel-Lindau.3
Etiología
La enfermedad se manifiesta mediante un patrón autosómico dominante. Está relacionada con una mutación genética en la síntesis del gen supresor tumoral de von Hippel-Lindau (VHL), situado en el cromosoma 3. Según establece la hipótesis de Knudson, para que se exprese el fenotipo, es necesario que el individuo sea
Síntomas y desarrollo
En los enfermos del síndrome de von Hippel-Lindau se observa la proliferación de tumores, de los cuales lo más esencial -desde el punto de vista clínico- es su localización en el cerebro, la médula espinal, la retina y los riñones. Aparte de esto, muchas otras alteraciones clínicas pueden afectar a otros órganos y sistemas. Los tumores que responden al síndrome de von Hippel-Lindau se caracterizan, por lo general, por sus múltiples focos, y del mismo modo se multiplican más rápidamente en un paciente joven que en la población de edad más avanzada.
Rasgos
Los rasgos del VHL son:
- Angiomatosis - pequeños nodulos de capilares en la retina y otros órganos.
- Hemangioblastomas - tumores del sistema nervioso central (especialmente en el cerebelo, tronco del encéfalo y médula espinal).
- Feocromocitoma - tumores de la médula adrenal que frecuentemente producen catecolaminas.
- Carcinoma de células renales - tumores malignos del riñón.
- Páncreas - cistos y tumores del páncreas, que pueden ser tumores neuroendocrinos.
Sin tratamiento, el VHL puede provocar ceguera y daño cerebral permanente. El fallecimiento sobreviene habitualmente por complicaciones de los tumores cerebrales o renales y enfermedades cardiovasculares secundarias al feocromocitoma. Con una detección temprana y el tratamiento apropiado, hoy en día hay más esperanzas que nunca para las personas con VHL.
Pronóstico
El pronóstico de los pacientes con la enfermedad de von Hippel-Lindau está directamente relacionado con el conocimiento de los antecedentes genéticos familiares, y con la frecuencia de exámenes periódicos personales. Ya que cerca de un 97% de los casos cuentan con antecedentes familiares conocidos, es posible establecer un diagnóstico temprano que se basa en el historial genético familiar. En los estudios realizados a gran escala con grupos de afectados por el síndrome en el sureste de Inglaterra, la causa de muerte más común se debía a complicaciones vasculares en el cerebelo (47,7%), y la esperanza de vida rondaba los 41 años.8 portador de la mutación en uno de los alelos, y posteriormente la mutación somáticadel segundo. A este mecanismo se le conoce como pérdida de heterocigosidad (abreviado como LOH, por sus siglas en inglés: loss of heterozygosity).4 En la mayoría de los afectados por el síndrome, la mutación constitutiva del gen VHL es heredada del progenitor, y la mutación de novo es la responsable del 15% de los casos de la enfermedad de von Hippel-Lindau.5 Muy raramente, la mutación se origina en la etapa embrionaria. En ese momento la presencia del gen es sólo parcial en el embrión aún no formado (mosaicismo).6 Se ha probado que elpolimorfismo en el gen de la ciclina D1 (CCND1) en el locus 11q13 puede verse modificado en fenotipos afectados por la mutación del gen VHL.7Patofisiología
El producto de la proteína clara del gen VHL tiene una longitud de 213 aminoácidos y su funcionamiento se relaciona con la proteína clara elongina-B y elongina-C. Esta relación en el complejo VHL-elongina B-elongina C mantiene la ligazón entre las proteínas claras especificadas y es la base de su ubicvitinación (el complejo tiene un nivel de estructura proteínica E3). Se afirmó que los sustratos del complejo VBC son las proteínas claras HIF1α y HIF2α, junto a la proteína clara atípica λ (de kinaza??); cuando esta ligadura tiene lugar se establece la proteína clara domena βVHL; por ello la proteínas claras quedan sujeta a ubicvitinación y determinadas por la misma, degradándose a proteasomas.
Historia
Eugen von Hippel fue quien primero describió los angiomas oculares (1904),9 y Arvid Lindau describió los angiomas del cerebelo y la espina dorsal en 1927.10
En un artículo que apareció en Associated Press, los endocrinólogos de la Universidad Vanderbilt que la hostilidad subyacente a la reyerta de Hatield-MacCoy podría haber sido debida en parte a las consecuencias del Síndrome de von Hippel-Lindau. El artículo sugiere que la familia McCoy tenía predisposición al mal temperamento porque muchos de ellos padecían feocromocitoma, que producía un exceso de adrenalina y tendencia hacia un temperamento explosivo.11 Los feocromocitomas producen oleadas de adrenalina que son frecuentemente percibidas como ataques de pánico y de ira. Sin tratamiento, pueden provocar serios problemas cardiovasculares, ataques al corazón y accidentes cerebrovasculares. Solo el 20% de las personas con VHL desarrollan feocromocitomas.12
Tipos
Hay varios subtipos:
- Tipo 1 (angiomatosis sin feocromocitoma)
- Tipo 2 (angiomatosis con feocromocitoma)
- Tipo 2A (riesgo bajo de carcinoma de células renales)
- Tipo 2B (alto riesgo de carcinoma de células renales)
- Tipo 2C (Sólo feocromocitoma sin angiomatosis ni carcinoma de células renales)
Genética
La causa de la enfermedad es una mutación que afecta al gen oncosupresor VHL, el cual se encuentra en el brazo corto del cromosoma 3.
Existe una amplia variedad en cuanto a la edad de inicio de la enfermedad, el órgano afectado y la gravedad del efecto. La mayor parte de los afectados del síndrome de von Hippel-Lindau heredan una copia alterada del gen, de uno de los progenitores. No obstante, en aproximadamente un 20% de los casos el gen alterado es el resultado de una nueva mutación que se da durante la formación de las células germinales o en el desarrollo embrionario.
Puesto que una copia del gen VHL normal produce una proteína funcional (pVHL), no se forman tumores. Pero si se produce una mutación en la segunda copia del gen a lo largo de la vida del afectado, la célula se quedará sin copias funcionales y no producirá la proteína VHL. La carencia de esta proteína permitirá desarrollarse a los tumores típicos del síndrome.
Sinonimia
Otros nombres son: Angiomatosis cerebelorretiniana, angiofacomatosis de retina y cerebelo, angiomatosis familiar, hemangioblastomatosis cerebelo-retiniana y enfermedad de von Hippel.
Referencias
- ↑ Maher ER, L. Iselius, JRW Yates, M. Littler, C. Benjamin, R. Harris, J. Sampson, A. Williams, M.A. Ferguson-Smith, N. Morton; "Von Hippel-Lindau disease: a genetic study", en J Med Genet, nº 28, págs. 443-447, 1991. (en inglés).
- ↑ HPH. Neumann y O.D. Wiestler; "Clustering of features of von Hippel-Lindau syndrome: evidence for a complex genetic locus", en Lancet,nº 337, págs. 1052-1054, 1991. (en inglés).
- ↑ C. Cybulski, K. Krzystolik, J. Lubiński; "Nowotwory dziedziczne 2002. Profilaktyka, diagnostyka, leczenie", ed. Termedia Wydawnictwa Medyczne, Poznań (Polonia) 2000.
- ↑ (1971) «Mutation and cancer: statistical study of retinoblastoma» (en inglés). PNAS (Proc Natl Acad Sci USA). Vol. 68. n.º 4. pp. 80-223.
- ↑ F.M. Richards, S.J. Payne, B. Zbar, N.A. Affara, M.A. Ferguson-Smith, E.R. Maher «Molecular analysis of de novo germline mutations in the von Hippel-Lindau disease gene» (en inglés). Hum Mol Genet. n.º 4. pp. 2139-2143.
- ↑ M.T. Sgambati, C. Stolle, P.L. Choyke, M.M. Walther, S. Pack, W.M. Lineham, G.M. Glenn (2000) «Mosaicism in von Hippel-Lindau disease: lessons from kindreds with germline mutations identified in offspring with mosaic parents» (en inglés). Am. J. Hum. Genet. Vol. 66. n.º 1. pp. 84-91. PMID 10631138.
- ↑ M- Zatyka, N.F. da Silva, S.C. Clifford, M.R. Morris, M.S. Wiesener, K.U. Eckardt, R.S. Houlston, F.M. Richards, F. Latif, E.R. Maher «Identification of cyclin D1 and other novel targets for the von Hippel-Lindau tumor suppressor gene by expression array analysis and investigation of cyclin D1 genotype as a modifier in von Hippel-Lindau disease» (en inglés). Cancer Res. Vol. 62. n.º 13. pp. 3803-3811.
- ↑ I.R. Maddock, A. Moran, E.R. Maher, A. Norman, S.J. Payne, R. Whitehouse, C. Dodd, M. Lavin, N. Hartley, et al.; "A genetic register for von Hippel-Lindau disease", en J Med Genet, nº 33, págs. 120-127
- ↑ Von Hippel E. Ueber eine sehr seltene Erkrankung der Netzhaut. Albrecht von Graefes Arch Ophthal 1904;59:83-106.
- ↑ Lindau A. Zur Frage der Angiomatosis Retinae und Ihrer Hirncomplikation. Acta Ophthal 1927;4:193-226.
- ↑ (2007-04-05) «Hatfield-McCoy feud blamed on ‘rage’ disease» MSNBC.com. Consultado el 2007-04-05.
- ↑ (2007-04-05) «'Pheochromocytoma Information'» vhl.org. Consultado el 2007-04-05.
Enlaces externos
Suscribirse a:
Entradas (Atom)